中学理科のダニエル電池は、定期テストで計算・選択・記述問題まで幅広く出題される重要単元です。
亜鉛板と銅板のどちらが溶けるのか、電子はどちらからどちらへ移動するのかを正確に理解しているかが得点の分かれ目になります。
しかし、
「なぜ亜鉛が溶けるの?」
「電子の向きが毎回あやふや」
「図はわかるけど文章で説明できない」
と苦手に感じる人も少なくありません。
この記事では、定期テストに頻出するダニエル電池の重要問題を中心に、
・ダニエル電池の基本的な仕組み
・電子・電流・イオンの動き
・記述問題で点が取れる考え方
を図のイメージと一緒に、順を追ってわかりやすく解説します。
「丸暗記」ではなく「理由がわかる」ことを重視したテスト対策記事です。
【問題】ダニエル電池の重要問題
下の図は、ダニエル電池のしくみを模式的に表したものである。これについて、以下の各問いに答えよ。
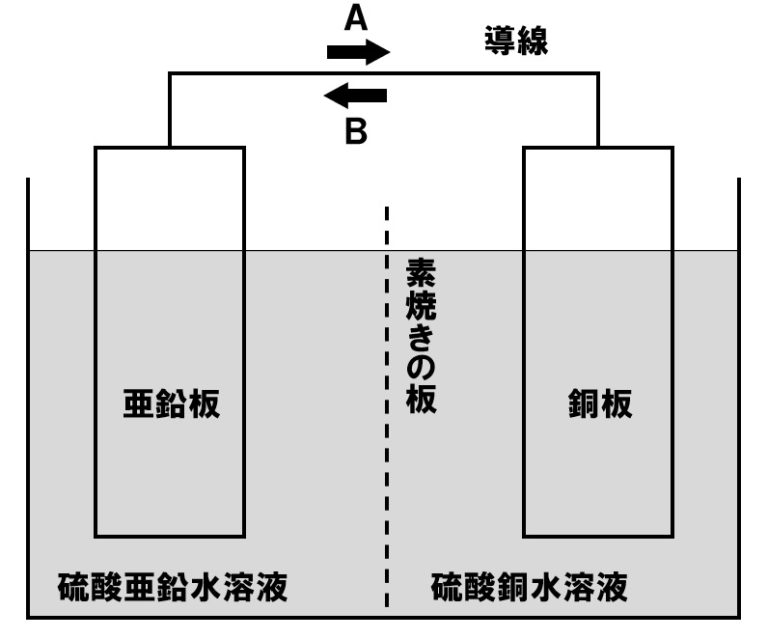
(1)図の装置で、導線に電流が流れる向きと、電子が移動する向きはAとBのどちらか。それぞれ記号で答えよ。
(2)電流を流したとき亜鉛板で起こる変化を、次の中から選び、記号で答えよ。
ア Zn+2e⁻→Zn²⁺ イ Zn→Zn²⁺+2e⁻ ウ Zn²⁺+2e⁻→Zn エ Zn²⁺→Zn+2e⁻
(3)素焼きの板を通って、硫酸銅水溶液から硫酸亜鉛水溶液のほうへ移動するイオンをイオン式で書け。
(4)電流を流し続けると、銅板の質量はどうなるか。
【解答・解説】ダニエル電池の重要問題の解答
(1)電流:B 電子:A
銅板が+極、亜鉛板がー極になります。電流は+極からー極に流れ、電子はー極から+極に移動します。
(2)イ
亜鉛は銅よりもイオン化傾向が大きいので、水溶液中に溶けて亜鉛イオンになります。このとき電子を2個放出します。
(3)SO₄²⁻
電流を流し続けると、硫酸亜鉛水溶液中にZn²⁺が多くある状態になります。亜鉛板側が+の電気を帯びるので、陰イオンである硫酸イオンが素焼き版を通過し亜鉛板側に移動します。
(4)増加する
銅板には、硫酸銅水溶液中の銅イオンが電子を受け取り銅原子になってくっつきます。

コメント