高校入試の理科は、物理・化学・生物・地学の幅広い分野から出題され、計算問題や実験観察の記述なども多く、中学生にとって得点差がつきやすい科目です。
本記事では、最新の入試傾向をふまえた理科の予想問題を分野別に掲載し、丁寧な解答・解説付きで理解を深められるよう構成しました。入試本番で力を発揮するために、ぜひ繰り返し練習に役立ててください。
【問題】中学理科まとめテスト(化学分野編)の問題
【問1】下の図のように、酸化銅の粉末をステンレス皿の上に広げ、ガスバーナーで加熱した。これについて、次の各問いに答えなさい。
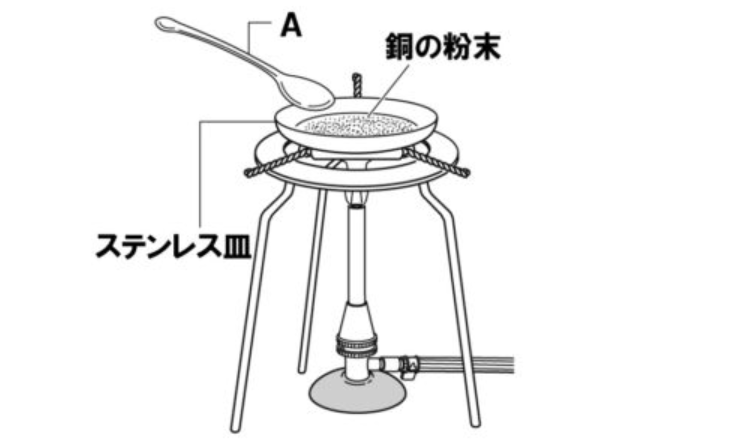
(1)銅粉をステンレス皿の上に乗せ加熱する際、どのように加熱するか。加熱の方法とその理由を、それぞれ簡潔に答えなさい。
(2)銅粉をステンレス皿の上で加熱したときの色の変化として正しいものを、次のア~エの中から一つ選び記号で答えなさい。
ア 黒色の物質が光を激しく出し、赤褐色になる。
イ 黒色の物質が赤熱し、赤褐色になる。
ウ 赤褐色の物質が光を激しく出し。黒色になる。
エ 赤褐色の物質が赤熱し、黒色になる。
(3)銅粉が受けた化学変化の名称を答えなさい。
(4)このときの化学変化を、化学反応式で表しなさい。
(5)銅と空気中の酸素は4:1の質量比で反応することがわかっている。3.6gの銅粉を加熱し完全に反応させた場合、加熱後の物質は何gになるか。
(6)図中の器具Aの名称を答えなさい。
(7)マグネシウムリボンを空気中で加熱したときは、燃焼という化学変化が起こった。燃焼とはどのような化学変化か。簡単に説明しなさい。
(8)(7)では酸化マグネシウムができるが、酸化マグネシウムの色として正しいものを、下のア~エの中から選び、記号で答えよ。
ア 黒色 イ 白色 ウ 赤褐色 エ 青色
(9)マグネシウムが燃焼して酸化マグネシウムができる化学変化を、化学反応式で書け。
【問2】A班からD班は、マグネシウムをステンレス皿に入れ十分に加熱する実験を行った。表はそのときの、加熱前のマグネシウムの質量と、生じた白い物質の質量を記録したものである。これについて、次の各問いに答えよ。
| A班 | B班 | C班 | D班 | |
| マグネシウムの質量〔g〕 | 0.3 | 0.6 | 0.9 | 1.2 |
| 白色の物質の質量〔g〕 | 0.5 | 1.0 | 1.5 | 2.0 |
(1)この実験から、マグネシウムと酸素は、質量比何対何で反応することが分かるか。最も簡単な整数比で答えよ。
(2)次にE班が、マグネシウム2.7gを同じように十分に反応させると、白い物質が生じた。この白い物質は何g生じたか。
(3)次にF班も同じように、マグネシウム1.5gを加熱したが、加熱の仕方が不十分だったため、加熱後の質量は2.1gにしかならなかった。未反応のマグネシウムは何gか。
(4)銅と酸素は質量比4:1で反応することが知られている。同じ質量の銅とマグネシウムと化合する酸素の質量比を答えよ。
【問3】図1はマツの花を、図2はある花の断面をスケッチしたものである。次の各問いに答えなさい。
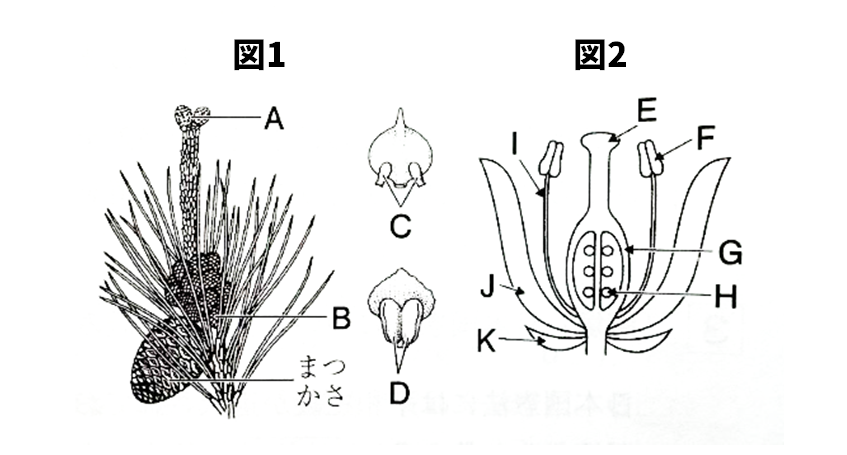
(1)図1、2のA、C、D、G、Jの名称を答えなさい。
(2)図1のまつかさは、A、Bどちらからできたものか。記号で答えなさい。
(3)図1のA~Dのなかで、種子になる部分はどこか。記号で答えなさい。
(4)(3)の部分は、図2ではどこにあたりますか。E~Kから選びなさい。
【問4】光について、次の各問いに答えよ。
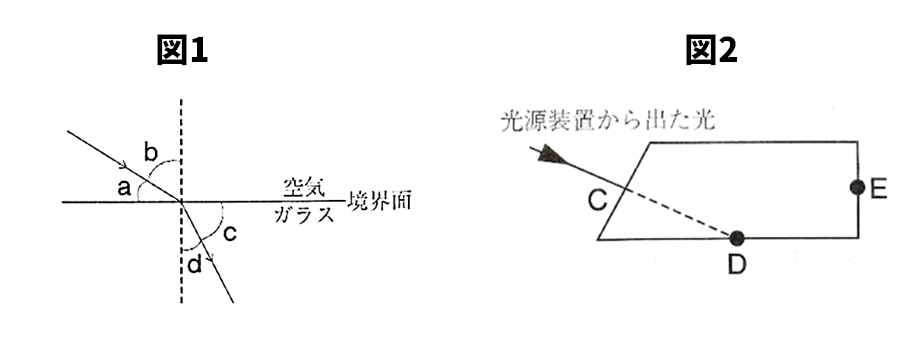
(1)図1で、入射角と屈折角はどれか。図中a~dからそれぞれ1つずつ選び、記号で答えよ。
(2)図2で、台形ガラスの点Cに光源装置を用いて光を当てたところ、光は点Eから出てくるのが観測された。
このように光が点Dから出てこないような現象のことを何というか。
(3)(2)の現象を利用したものを、次のア~ウから1つ選び、記号で答えよ。
ア レーザー
イ 光ファイバー
ウ カメラ
【問5】気象に関する文章を読み、次の各問に答えよ。
夏の気圧配置は「南高北低」といわれ、日本の南側に高気圧が居座り、その高気圧から( オ )に風が吹き出しており、それに伴って南から暖かく湿った空気が日本付近に流入してきます。これにより雲ができやすい状態になります。
(1)文中の(ア)~(ウ)に適する語句の組み合わせとして正しいものを次の1~4から1つ選び、番号で答えよ。
| ア | イ | ウ | |
|---|---|---|---|
| 1 | 暖かい | 冷たい | 上がり |
| 2 | 冷たい | 暖かい | 下がり |
| 3 | 暖かい | 冷たい | 下がり |
| 4 | 冷たい | 暖かい | 上がり |
(2)文中の(エ)に適する語句を漢字で答えよ。
(3)文中の(オ)に適する語句を次の1~4から1つ選び、番号で答えよ。
1 北向き
2 南向き
3 時計回り
4 反時計周り
【問6】下図のような容器に、うすい塩酸と炭酸水素ナトリウムを入れ、容器のふたをしたまま容器を傾け、うすい塩酸と炭酸水素ナトリウムを十分に反応させた。反応前の全体の質量をW₁〔g〕、反応後の全体の質量をW₂〔g〕として、次の各問いに答えよ。
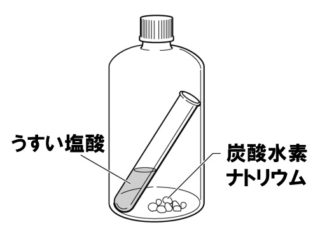
(1)うすい塩酸と炭酸水素ナトリウムの反応で発生する気体は何か。
(2)この化学変化の化学反応式は左辺は次のようになる。右辺を完成させよ。
HCl + NaHCO₃ → ( )
(3)W₁とW₂の間に成り立つ関係を、式で表しなさい。
(4)「化学変化に関係する物質全体の質量が変化しない」という法則を何というか。
(5)次の文は(4)を説明したものである。文中の( )に適する語を入れよ。
(6)うすい塩酸と炭酸水素ナトリウムを十分に反応させた後、容器のふたをゆるめると、容器全体の質量は反応前に比べてどうなるか。
(7)(6)のようになるのはなぜか。理由を簡潔に答えよ。
【解答・解説】中学理科まとめテスト(化学分野編)の解答
【問1】
(1)加熱の方法:うすく広げるようにかき混ぜながら加熱する。 理由:銅粉と空気中の酸素を完全に反応させるため。
銅粉と空気中の酸素を完全に反応させるため、うすく広げるようにかき混ぜながら加熱します。
(2)エ
赤褐色の銅粉は空気中の酸素と化合し、黒色の酸化銅になります。このとき、光や熱を激しく出すのではなく、赤熱しながら反応が進みます。
(3)酸化
物質と酸素が化合する化学変化なので、酸化となります。
化学変化の種類
・分解…1種類の物質が2種類以上の別の物質になる化学変化。
・化合…2種類以上の物質が結び付き別の物質になる化学変化。
・酸化…物質と酸素が化合する化学変化。
・燃焼…光や熱を激しく出しながら酸化すること。
・還元…酸化物から酸素を取り去る化学変化。
(4)2Cu+O₂→2CuO
銅の化学式はCu、酸素の化学式はO2、酸化銅の化学式はCuOです。化学変化の前後で原子の個数が一致するように係数をつけます。
(5)4.5g
銅と酸素は4:1で反応します。したがって、銅と酸素とできる酸化銅の質量比は4:1:5になります。3.6gの銅を加熱し、何gの酸化銅ができるか聞いているので、4:5の質量比を使って計算します。
4:5=3.6:x
x=4.5
覚えるべき質量比!
❶銅:酸素:酸化銅=4:1:5
❷マグネシウム:酸素:酸化マグネシウム=3:2:5
❸鉄:硫黄:硫化鉄=7:4:11
(6)薬さじ
(7)光や熱を激しく出しながら酸化すること。
燃焼とは、酸化の中でも光や熱を激しく出す化学変化になります。
(8)イ
マグネシウムが酸化してできる酸化マグネシウムの色は白色になります。
入試に出る酸化物の色!
❶酸化銅…黒色
❷酸化銀…黒色
❸酸化鉄…黒色
❹酸化マグネシウム…白色
(9)2Mg+O₂→2MgO
酸化マグネシムの化学式はMgOです。化学反応式の両辺で酸素原子の数が一致しないので、右辺のMgOを2倍にし、さらに左辺のMgを2倍にすると原子の数が一致します。
【問2】
(1)この実験から、マグネシウムと酸素は、質量比何対何で反応することが分かるか。最も簡単な整数比で答えよ。
3:2
どの班の結果を使っても同じになりますが、A班の結果で考えてみると、0.3gのマグネシウムが加熱後に0.5gになっています。
0.5-0.3=0.2
0.3gのマグネシウムに0.2gの酸素が化合しているので、
0.3:0.2=3:2
マグネシウム:酸素:酸化マグネシウム=3:2:5 は覚えておきましょう。
(2)次にE班が、マグネシウム2.7gを同じように十分に反応させると、白い物質が生じた。この白い物質は何g生じたか。
4.5g
マグネシウムと酸化マグネシウムの質量比は3:5なので、
3:5=2.7:x
x=4.5
(3)次にF班も同じように、マグネシウム1.5gを加熱したが、加熱の仕方が不十分だったため、加熱後の質量は2.1gにしかならなかった。未反応のマグネシウムは何gか。
0.6g
化合した酸素は、
2.1-1.5=0.6g
反応したマグネシウムは、
3:2=x:0.6
x=0.9g
未反応のマグネシウムは、
1.5-0.9=0.6g
(4)銅と酸素は質量比4:1で反応することが知られている。同じ質量の銅とマグネシウムと化合する酸素の質量比を答えよ。
銅と化合する酸素:マグネシウムと化合する酸素=3:8
銅:酸素=4:1
マグネシウム:酸素=3:2
ここで金属の比をそろえると、
銅:酸素=12:3
マグネシウム:酸素=12:8
したがって、同じ質量の銅とマグネシウムと化合する酸素の質量比は、
3:8
【問3】
(1)
A めばなの集まり(めばな)
C 胚珠
D やく(花粉ぶくろ)
G 子房
J 花弁(花びら)
(2)A
(3)C
(4)H
【問4】
(1)
入射角:b
屈折角:d
(2)全反射
(3)イ
【問5】
(1)3
(2)凝結
(3)3
【問6】
(1)うすい塩酸と炭酸水素ナトリウムの反応で発生する気体は何か。
二酸化炭素
うすい塩酸と炭酸水素ナトリウムを混ぜると、気体の二酸化炭素と、液体の水、固体の塩化ナトリウムが生じます。とにかく、炭酸水素ナトリウムとくれば二酸化炭素です。
(2)この化学変化の化学反応式は左辺は次のようになる。右辺を完成させよ。
HCl + NaHCO₃ → ( NaCl + CO₂ + H₂O )
(3)W₁とW₂の間に成り立つ関係を、式で表しなさい。
W₁=W₂
密閉容器内で気体を発生させても、発生した気体が空気中に逃げていかないので、質量は変化しません。
(4)「化学変化に関係する物質全体の質量が変化しない」という法則を何というか。
質量保存の法則
(5)次の文は(4)を説明したものである。文中の( )に適する語を入れよ。
化学変化では、原子そのものは変化しません。種類も数も変化しないので物質全体の質量は変化しません。原子の組み合わせ(結びつき方)は変化するので、物質の性質は変化します。
(6)うすい塩酸と炭酸水素ナトリウムを十分に反応させた後、容器のふたをゆるめると、容器全体の質量は反応前に比べてどうなるか。
小さくなる(減少する)
発生した二酸化炭素が空気中に出ていった分、質量は減少します。
(7)(6)のようになるのはなぜか。理由を簡潔に答えよ。
発生した気体が空気中に逃げて行ったから。

コメント